QUÍMICA TECNOLÓGICA
Em siderúrgicas a produção de ferro puro pode ocorrer através da reação química:
CO(g) + FeO(s) → Fe(s) + CO2(g)
Admita que a amostra de FeO tenha 60% em massa de pureza. Nestas condições, para cada mol de ferro produzido, a massa de FeO impuro necessária será: (massas atômicas: Fe = 56, O = 16)
56 g.
43 g.
60 g.
120 g.
72 g.
A Ureia é um composto com muitas utilidades diferentes. Ela pode ser utilizada na alimentação de animais ruminantes, fabricação de plásticos, para aumentar a solubilidade de corantes na indústria têxtil, na fabricação de fertilizantes agrícolas, etc. Baseado na fórmula estrutural abaixo, determine a massa de nitrogênio em um saco de 60 kg desse material. (Massas atômicas: C % 12; O % 16; N % 14; H % 1.)
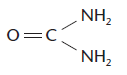
8 kg
56 kg
14 kg
35 kg
28 kg
O etanol, pode sofrer combustão completa, de acordo com a reação escrita abaixo:
C2H6O + 3 O2 ----> 2 CO2 + 3 H2O
De acordo com a estequiometria da reação, 10 g de etanol reagem com certa massa de oxigênio, produzindo 19 g de gás carbônico e 12 g de água. Pode-se afirmar que a massa de oxigênio necessária para reagir completamente com todo o álcool usado é de:
21 g.
32 g.
64 g.
12 g.
18 g.
Ao analisar dois átomos, de elementos genéricos A e B, um aluno determinou que eles apresentam as seguintes distribuições eletrônicas em camadas: A = 2, 8, 1 e B = 2, 8, 6. Observando esses dados, e a ligação química ocorrida entre A e B, o aluno fez as seguintes afirmações:
I. O átomo A perde 1 elétron e transforma-se em um íon (cátion) monovalente.
II. A fórmula correta do composto formado é A2B e a ligação que se processa é do tipo iônica.
III. O átomo B cede 2 elétrons e transforma-se em um ânion bivalente.
Assinale a alternativa que contem somente afirmações corretas:
Apenas I e II são corretas.
Todas as afirmativas são corretas.
Apenas I é correta
Apenas II e III são corretas.
Apenas II é correta.
O óxido de alumínio (Al2O3) é utilizado na elaboração de vários medicamentos, como antiácido. Ao ingerir um medicamento contendo esse composto químico, a reação que ocorre no estômago é:
x Al2O3 + y HCl ----> z AlCl3 + w H2O
Os coeficientes x, y, z e w são, respectivamente:
2, 3, 1 e 6
4, 2, 1 e 6
1, 2, 3 e 6
1, 6, 2 e 3
2, 4, 4 e 3
A energia gerada sob condições não padrões (ΔE), pode ser calculada utilizando-se a equação de Nernst:

Considerando a equação química abaixo, com as concentrações molares dos íons Zn2+ e Cu2+ , 5 mol/L e 0,05 mol/L, respectivamente, assinale a alternativa que contem a ΔE gerada.
Zn(s) + Cu2+(aq) --> Zn2+(aq) + Cu(s) ΔE0 = 1,100 V.
ΔE = 2,000 V
ΔE = 3,871 V
ΔE = 0,218 V
ΔE = 1,041 V
ΔE = 0,782 V
O ferro galvanizado apresenta-se revestido por uma camada de zinco. Se um objeto desse material for riscado, o ferro ficará exposto às condições do meio ambiente e poderá formar o hidróxido ferroso. Nesse caso, o zinco, por ser mais reativo, regenera o ferro, conforme a reação representada a seguir.
Fe(OH)2 + Zn = Zn(OH)2 + Fe
Sobre essa reação, pode-se afirmar que:
Dados: Fe2+ + 2 e- → Fe0 E0red = - 0,44 v
Zn2+ + 2e- → Zn0 E0red = - 0,77 v
o ferro sofre oxidação, pois perderá elétrons.
o ferro sofre redução, pois perderá elétrons.
o zinco sofre oxidação, pois perderá elétrons.
o zinco sofre redução, pois ganhará elétrons.
o ferro sofre oxidação, pois ganhará elétrons.
Analisando as configurações eletrônicas de quatro elementos químicos, dispostos abaixo:
I. 1s2 2s2.
II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 .
III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 .
IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
Qual deles apresenta tendência a formar um ânion?
Apenas o I e o III.
Apenas o III.
Apenas o II e o IV.
Apenas o IV.
Apenas o II.
No equilíbrio 2 HI (g) <===> H2 (g) + I2 (g) , encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 1 x 10-3 ?
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L
A produção de semi-condutores tem como fundamento a dopagem de um composto isolante, ou seja, contaminando um material não-condutor com alguns átomos de elementos químicos específicos, produzimos um semi-condutor. Um dos processos de produção desses semi-condutores, apresenta a reação : SiO2 (s) + 2C ( s ) -----> Si(l) + 2 CO (g) . Sabendo que esse processo apresenta um rendimento de 70% para produção de silício no estado líquido, determine a massa de silício formada quando utilizamos 450 g de dióxido de silício na reação? Massa atômica: Si = 28 u. ; O = 16 u. ; C = 12 u.
56 g.
43 g.
60 g.
120 g.
72 g.
A Ureia é um composto com muitas utilidades diferentes. Ela pode ser utilizada na alimentação de animais ruminantes, fabricação de plásticos, para aumentar a solubilidade de corantes na indústria têxtil, na fabricação de fertilizantes agrícolas, etc. Baseado na fórmula estrutural abaixo, determine a massa de nitrogênio em um saco de 60 kg desse material. (Massas atômicas: C % 12; O % 16; N % 14; H % 1.)

8 kg
56 kg
14 kg
35 kg
28 kg
O etanol, pode sofrer combustão completa, de acordo com a reação escrita abaixo:
C2H6O + 3 O2 ----> 2 CO2 + 3 H2O
De acordo com a estequiometria da reação, 10 g de etanol reagem com certa massa de oxigênio, produzindo 19 g de gás carbônico e 12 g de água. Pode-se afirmar que a massa de oxigênio necessária para reagir completamente com todo o álcool usado é de:
21 g.
32 g.
64 g.
12 g.
18 g.
Ao analisar dois átomos, de elementos genéricos A e B, um aluno determinou que eles apresentam as seguintes distribuições eletrônicas em camadas: A = 2, 8, 1 e B = 2, 8, 6. Observando esses dados, e a ligação química ocorrida entre A e B, o aluno fez as seguintes afirmações:
I. O átomo A perde 1 elétron e transforma-se em um íon (cátion) monovalente.
II. A fórmula correta do composto formado é A2B e a ligação que se processa é do tipo iônica.
III. O átomo B cede 2 elétrons e transforma-se em um ânion bivalente.
Assinale a alternativa que contem somente afirmações corretas:
Apenas I e II são corretas.
Todas as afirmativas são corretas.
Apenas I é correta
Apenas II e III são corretas.
Apenas II é correta.
O óxido de alumínio (Al2O3) é utilizado na elaboração de vários medicamentos, como antiácido. Ao ingerir um medicamento contendo esse composto químico, a reação que ocorre no estômago é:
x Al2O3 + y HCl ----> z AlCl3 + w H2O
Os coeficientes x, y, z e w são, respectivamente:
2, 3, 1 e 6
4, 2, 1 e 6
1, 2, 3 e 6
1, 6, 2 e 3
2, 4, 4 e 3
A energia gerada sob condições não padrões (ΔE), pode ser calculada utilizando-se a equação de Nernst:

Considerando a equação química abaixo, com as concentrações molares dos íons Zn2+ e Cu2+ , 5 mol/L e 0,05 mol/L, respectivamente, assinale a alternativa que contem a ΔE gerada.
Zn(s) + Cu2+(aq) --> Zn2+(aq) + Cu(s) ΔE0 = 1,100 V.
ΔE = 2,000 V
ΔE = 3,871 V
ΔE = 0,218 V
ΔE = 1,041 V
ΔE = 0,782 V
O ferro galvanizado apresenta-se revestido por uma camada de zinco. Se um objeto desse material for riscado, o ferro ficará exposto às condições do meio ambiente e poderá formar o hidróxido ferroso. Nesse caso, o zinco, por ser mais reativo, regenera o ferro, conforme a reação representada a seguir.
Fe(OH)2 + Zn = Zn(OH)2 + Fe
Sobre essa reação, pode-se afirmar que:
Dados: Fe2+ + 2 e- → Fe0 E0red = - 0,44 v
Zn2+ + 2e- → Zn0 E0red = - 0,77 v
o ferro sofre oxidação, pois perderá elétrons.
o ferro sofre redução, pois perderá elétrons.
o zinco sofre oxidação, pois perderá elétrons.
o zinco sofre redução, pois ganhará elétrons.
o ferro sofre oxidação, pois ganhará elétrons.
Analisando as configurações eletrônicas de quatro elementos químicos, dispostos abaixo:
I. 1s2 2s2.
II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 .
III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 .
IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
Qual deles apresenta tendência a formar um ânion?
Apenas o I e o III.
Apenas o III.
Apenas o II e o IV.
Apenas o IV.
Apenas o II.
No equilíbrio 2 HI (g) <===> H2 (g) + I2 (g) , encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 1 x 10-3 ?
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L
A produção de semi-condutores tem como fundamento a dopagem de um composto isolante, ou seja, contaminando um material não-condutor com alguns átomos de elementos químicos específicos, produzimos um semi-condutor. Um dos processos de produção desses semi-condutores, apresenta a reação : SiO2 (s) + 2C ( s ) -----> Si(l) + 2 CO (g) . Sabendo que esse processo apresenta um rendimento de 70% para produção de silício no estado líquido, determine a massa de silício formada quando utilizamos 450 g de dióxido de silício na reação? Massa atômica: Si = 28 u. ; O = 16 u. ; C = 12 u.

8 kg
56 kg
14 kg
35 kg
28 kg
O etanol, pode sofrer combustão completa, de acordo com a reação escrita abaixo:
C2H6O + 3 O2 ----> 2 CO2 + 3 H2O
De acordo com a estequiometria da reação, 10 g de etanol reagem com certa massa de oxigênio, produzindo 19 g de gás carbônico e 12 g de água. Pode-se afirmar que a massa de oxigênio necessária para reagir completamente com todo o álcool usado é de:
21 g.
32 g.
64 g.
12 g.
18 g.
Ao analisar dois átomos, de elementos genéricos A e B, um aluno determinou que eles apresentam as seguintes distribuições eletrônicas em camadas: A = 2, 8, 1 e B = 2, 8, 6. Observando esses dados, e a ligação química ocorrida entre A e B, o aluno fez as seguintes afirmações:
I. O átomo A perde 1 elétron e transforma-se em um íon (cátion) monovalente.
II. A fórmula correta do composto formado é A2B e a ligação que se processa é do tipo iônica.
III. O átomo B cede 2 elétrons e transforma-se em um ânion bivalente.
Assinale a alternativa que contem somente afirmações corretas:
Apenas I e II são corretas.
Todas as afirmativas são corretas.
Apenas I é correta
Apenas II e III são corretas.
Apenas II é correta.
O óxido de alumínio (Al2O3) é utilizado na elaboração de vários medicamentos, como antiácido. Ao ingerir um medicamento contendo esse composto químico, a reação que ocorre no estômago é:
x Al2O3 + y HCl ----> z AlCl3 + w H2O
Os coeficientes x, y, z e w são, respectivamente:
2, 3, 1 e 6
4, 2, 1 e 6
1, 2, 3 e 6
1, 6, 2 e 3
2, 4, 4 e 3
A energia gerada sob condições não padrões (ΔE), pode ser calculada utilizando-se a equação de Nernst:

Considerando a equação química abaixo, com as concentrações molares dos íons Zn2+ e Cu2+ , 5 mol/L e 0,05 mol/L, respectivamente, assinale a alternativa que contem a ΔE gerada.
Zn(s) + Cu2+(aq) --> Zn2+(aq) + Cu(s) ΔE0 = 1,100 V.
ΔE = 2,000 V
ΔE = 3,871 V
ΔE = 0,218 V
ΔE = 1,041 V
ΔE = 0,782 V
O ferro galvanizado apresenta-se revestido por uma camada de zinco. Se um objeto desse material for riscado, o ferro ficará exposto às condições do meio ambiente e poderá formar o hidróxido ferroso. Nesse caso, o zinco, por ser mais reativo, regenera o ferro, conforme a reação representada a seguir.
Fe(OH)2 + Zn = Zn(OH)2 + Fe
Sobre essa reação, pode-se afirmar que:
Dados: Fe2+ + 2 e- → Fe0 E0red = - 0,44 v
Zn2+ + 2e- → Zn0 E0red = - 0,77 v
o ferro sofre oxidação, pois perderá elétrons.
o ferro sofre redução, pois perderá elétrons.
o zinco sofre oxidação, pois perderá elétrons.
o zinco sofre redução, pois ganhará elétrons.
o ferro sofre oxidação, pois ganhará elétrons.
Analisando as configurações eletrônicas de quatro elementos químicos, dispostos abaixo:
I. 1s2 2s2.
II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 .
III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 .
IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
Qual deles apresenta tendência a formar um ânion?
Apenas o I e o III.
Apenas o III.
Apenas o II e o IV.
Apenas o IV.
Apenas o II.
No equilíbrio 2 HI (g) <===> H2 (g) + I2 (g) , encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 1 x 10-3 ?
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L
A produção de semi-condutores tem como fundamento a dopagem de um composto isolante, ou seja, contaminando um material não-condutor com alguns átomos de elementos químicos específicos, produzimos um semi-condutor. Um dos processos de produção desses semi-condutores, apresenta a reação : SiO2 (s) + 2C ( s ) -----> Si(l) + 2 CO (g) . Sabendo que esse processo apresenta um rendimento de 70% para produção de silício no estado líquido, determine a massa de silício formada quando utilizamos 450 g de dióxido de silício na reação? Massa atômica: Si = 28 u. ; O = 16 u. ; C = 12 u.
21 g.
32 g.
64 g.
12 g.
18 g.
Ao analisar dois átomos, de elementos genéricos A e B, um aluno determinou que eles apresentam as seguintes distribuições eletrônicas em camadas: A = 2, 8, 1 e B = 2, 8, 6. Observando esses dados, e a ligação química ocorrida entre A e B, o aluno fez as seguintes afirmações:
I. O átomo A perde 1 elétron e transforma-se em um íon (cátion) monovalente.
II. A fórmula correta do composto formado é A2B e a ligação que se processa é do tipo iônica.
III. O átomo B cede 2 elétrons e transforma-se em um ânion bivalente.
Assinale a alternativa que contem somente afirmações corretas:
Apenas I e II são corretas.
Todas as afirmativas são corretas.
Apenas I é correta
Apenas II e III são corretas.
Apenas II é correta.
O óxido de alumínio (Al2O3) é utilizado na elaboração de vários medicamentos, como antiácido. Ao ingerir um medicamento contendo esse composto químico, a reação que ocorre no estômago é:
x Al2O3 + y HCl ----> z AlCl3 + w H2O
Os coeficientes x, y, z e w são, respectivamente:
2, 3, 1 e 6
4, 2, 1 e 6
1, 2, 3 e 6
1, 6, 2 e 3
2, 4, 4 e 3
A energia gerada sob condições não padrões (ΔE), pode ser calculada utilizando-se a equação de Nernst:

Considerando a equação química abaixo, com as concentrações molares dos íons Zn2+ e Cu2+ , 5 mol/L e 0,05 mol/L, respectivamente, assinale a alternativa que contem a ΔE gerada.
Zn(s) + Cu2+(aq) --> Zn2+(aq) + Cu(s) ΔE0 = 1,100 V.
ΔE = 2,000 V
ΔE = 3,871 V
ΔE = 0,218 V
ΔE = 1,041 V
ΔE = 0,782 V
O ferro galvanizado apresenta-se revestido por uma camada de zinco. Se um objeto desse material for riscado, o ferro ficará exposto às condições do meio ambiente e poderá formar o hidróxido ferroso. Nesse caso, o zinco, por ser mais reativo, regenera o ferro, conforme a reação representada a seguir.
Fe(OH)2 + Zn = Zn(OH)2 + Fe
Sobre essa reação, pode-se afirmar que:
Dados: Fe2+ + 2 e- → Fe0 E0red = - 0,44 v
Zn2+ + 2e- → Zn0 E0red = - 0,77 v
o ferro sofre oxidação, pois perderá elétrons.
o ferro sofre redução, pois perderá elétrons.
o zinco sofre oxidação, pois perderá elétrons.
o zinco sofre redução, pois ganhará elétrons.
o ferro sofre oxidação, pois ganhará elétrons.
Analisando as configurações eletrônicas de quatro elementos químicos, dispostos abaixo:
I. 1s2 2s2.
II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 .
III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 .
IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
Qual deles apresenta tendência a formar um ânion?
Apenas o I e o III.
Apenas o III.
Apenas o II e o IV.
Apenas o IV.
Apenas o II.
No equilíbrio 2 HI (g) <===> H2 (g) + I2 (g) , encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 1 x 10-3 ?
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L
A produção de semi-condutores tem como fundamento a dopagem de um composto isolante, ou seja, contaminando um material não-condutor com alguns átomos de elementos químicos específicos, produzimos um semi-condutor. Um dos processos de produção desses semi-condutores, apresenta a reação : SiO2 (s) + 2C ( s ) -----> Si(l) + 2 CO (g) . Sabendo que esse processo apresenta um rendimento de 70% para produção de silício no estado líquido, determine a massa de silício formada quando utilizamos 450 g de dióxido de silício na reação? Massa atômica: Si = 28 u. ; O = 16 u. ; C = 12 u.
Apenas I e II são corretas.
Todas as afirmativas são corretas.
Apenas I é correta
Apenas II e III são corretas.
Apenas II é correta.
O óxido de alumínio (Al2O3) é utilizado na elaboração de vários medicamentos, como antiácido. Ao ingerir um medicamento contendo esse composto químico, a reação que ocorre no estômago é:
x Al2O3 + y HCl ----> z AlCl3 + w H2O
Os coeficientes x, y, z e w são, respectivamente:
2, 3, 1 e 6
4, 2, 1 e 6
1, 2, 3 e 6
1, 6, 2 e 3
2, 4, 4 e 3
A energia gerada sob condições não padrões (ΔE), pode ser calculada utilizando-se a equação de Nernst:

Considerando a equação química abaixo, com as concentrações molares dos íons Zn2+ e Cu2+ , 5 mol/L e 0,05 mol/L, respectivamente, assinale a alternativa que contem a ΔE gerada.
Zn(s) + Cu2+(aq) --> Zn2+(aq) + Cu(s) ΔE0 = 1,100 V.
ΔE = 2,000 V
ΔE = 3,871 V
ΔE = 0,218 V
ΔE = 1,041 V
ΔE = 0,782 V
O ferro galvanizado apresenta-se revestido por uma camada de zinco. Se um objeto desse material for riscado, o ferro ficará exposto às condições do meio ambiente e poderá formar o hidróxido ferroso. Nesse caso, o zinco, por ser mais reativo, regenera o ferro, conforme a reação representada a seguir.
Fe(OH)2 + Zn = Zn(OH)2 + Fe
Sobre essa reação, pode-se afirmar que:
Dados: Fe2+ + 2 e- → Fe0 E0red = - 0,44 v
Zn2+ + 2e- → Zn0 E0red = - 0,77 v
o ferro sofre oxidação, pois perderá elétrons.
o ferro sofre redução, pois perderá elétrons.
o zinco sofre oxidação, pois perderá elétrons.
o zinco sofre redução, pois ganhará elétrons.
o ferro sofre oxidação, pois ganhará elétrons.
Analisando as configurações eletrônicas de quatro elementos químicos, dispostos abaixo:
I. 1s2 2s2.
II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 .
III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 .
IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
Qual deles apresenta tendência a formar um ânion?
Apenas o I e o III.
Apenas o III.
Apenas o II e o IV.
Apenas o IV.
Apenas o II.
No equilíbrio 2 HI (g) <===> H2 (g) + I2 (g) , encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 1 x 10-3 ?
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L
A produção de semi-condutores tem como fundamento a dopagem de um composto isolante, ou seja, contaminando um material não-condutor com alguns átomos de elementos químicos específicos, produzimos um semi-condutor. Um dos processos de produção desses semi-condutores, apresenta a reação : SiO2 (s) + 2C ( s ) -----> Si(l) + 2 CO (g) . Sabendo que esse processo apresenta um rendimento de 70% para produção de silício no estado líquido, determine a massa de silício formada quando utilizamos 450 g de dióxido de silício na reação? Massa atômica: Si = 28 u. ; O = 16 u. ; C = 12 u.
2, 3, 1 e 6
4, 2, 1 e 6
1, 2, 3 e 6
1, 6, 2 e 3
2, 4, 4 e 3
A energia gerada sob condições não padrões (ΔE), pode ser calculada utilizando-se a equação de Nernst:

Considerando a equação química abaixo, com as concentrações molares dos íons Zn2+ e Cu2+ , 5 mol/L e 0,05 mol/L, respectivamente, assinale a alternativa que contem a ΔE gerada.
Zn(s) + Cu2+(aq) --> Zn2+(aq) + Cu(s) ΔE0 = 1,100 V.
ΔE = 2,000 V
ΔE = 3,871 V
ΔE = 0,218 V
ΔE = 1,041 V
ΔE = 0,782 V
O ferro galvanizado apresenta-se revestido por uma camada de zinco. Se um objeto desse material for riscado, o ferro ficará exposto às condições do meio ambiente e poderá formar o hidróxido ferroso. Nesse caso, o zinco, por ser mais reativo, regenera o ferro, conforme a reação representada a seguir.
Fe(OH)2 + Zn = Zn(OH)2 + Fe
Sobre essa reação, pode-se afirmar que:
Dados: Fe2+ + 2 e- → Fe0 E0red = - 0,44 v
Zn2+ + 2e- → Zn0 E0red = - 0,77 v
o ferro sofre oxidação, pois perderá elétrons.
o ferro sofre redução, pois perderá elétrons.
o zinco sofre oxidação, pois perderá elétrons.
o zinco sofre redução, pois ganhará elétrons.
o ferro sofre oxidação, pois ganhará elétrons.
Analisando as configurações eletrônicas de quatro elementos químicos, dispostos abaixo:
I. 1s2 2s2.
II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 .
III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 .
IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
Qual deles apresenta tendência a formar um ânion?
Apenas o I e o III.
Apenas o III.
Apenas o II e o IV.
Apenas o IV.
Apenas o II.
No equilíbrio 2 HI (g) <===> H2 (g) + I2 (g) , encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 1 x 10-3 ?
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L
A produção de semi-condutores tem como fundamento a dopagem de um composto isolante, ou seja, contaminando um material não-condutor com alguns átomos de elementos químicos específicos, produzimos um semi-condutor. Um dos processos de produção desses semi-condutores, apresenta a reação : SiO2 (s) + 2C ( s ) -----> Si(l) + 2 CO (g) . Sabendo que esse processo apresenta um rendimento de 70% para produção de silício no estado líquido, determine a massa de silício formada quando utilizamos 450 g de dióxido de silício na reação? Massa atômica: Si = 28 u. ; O = 16 u. ; C = 12 u.

ΔE = 2,000 V
ΔE = 3,871 V
ΔE = 0,218 V
ΔE = 1,041 V
ΔE = 0,782 V
O ferro galvanizado apresenta-se revestido por uma camada de zinco. Se um objeto desse material for riscado, o ferro ficará exposto às condições do meio ambiente e poderá formar o hidróxido ferroso. Nesse caso, o zinco, por ser mais reativo, regenera o ferro, conforme a reação representada a seguir.
Fe(OH)2 + Zn = Zn(OH)2 + Fe
Sobre essa reação, pode-se afirmar que:
Dados: Fe2+ + 2 e- → Fe0 E0red = - 0,44 v
Zn2+ + 2e- → Zn0 E0red = - 0,77 v
o ferro sofre oxidação, pois perderá elétrons.
o ferro sofre redução, pois perderá elétrons.
o zinco sofre oxidação, pois perderá elétrons.
o zinco sofre redução, pois ganhará elétrons.
o ferro sofre oxidação, pois ganhará elétrons.
Analisando as configurações eletrônicas de quatro elementos químicos, dispostos abaixo:
I. 1s2 2s2.
II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 .
III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 .
IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
Qual deles apresenta tendência a formar um ânion?
Apenas o I e o III.
Apenas o III.
Apenas o II e o IV.
Apenas o IV.
Apenas o II.
No equilíbrio 2 HI (g) <===> H2 (g) + I2 (g) , encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 1 x 10-3 ?
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L
A produção de semi-condutores tem como fundamento a dopagem de um composto isolante, ou seja, contaminando um material não-condutor com alguns átomos de elementos químicos específicos, produzimos um semi-condutor. Um dos processos de produção desses semi-condutores, apresenta a reação : SiO2 (s) + 2C ( s ) -----> Si(l) + 2 CO (g) . Sabendo que esse processo apresenta um rendimento de 70% para produção de silício no estado líquido, determine a massa de silício formada quando utilizamos 450 g de dióxido de silício na reação? Massa atômica: Si = 28 u. ; O = 16 u. ; C = 12 u.
o ferro sofre oxidação, pois perderá elétrons.
o ferro sofre redução, pois perderá elétrons.
o zinco sofre oxidação, pois perderá elétrons.
o zinco sofre redução, pois ganhará elétrons.
o ferro sofre oxidação, pois ganhará elétrons.
Analisando as configurações eletrônicas de quatro elementos químicos, dispostos abaixo:
I. 1s2 2s2.
II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 .
III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 .
IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
Qual deles apresenta tendência a formar um ânion?
Apenas o I e o III.
Apenas o III.
Apenas o II e o IV.
Apenas o IV.
Apenas o II.
No equilíbrio 2 HI (g) <===> H2 (g) + I2 (g) , encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 1 x 10-3 ?
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L
A produção de semi-condutores tem como fundamento a dopagem de um composto isolante, ou seja, contaminando um material não-condutor com alguns átomos de elementos químicos específicos, produzimos um semi-condutor. Um dos processos de produção desses semi-condutores, apresenta a reação : SiO2 (s) + 2C ( s ) -----> Si(l) + 2 CO (g) . Sabendo que esse processo apresenta um rendimento de 70% para produção de silício no estado líquido, determine a massa de silício formada quando utilizamos 450 g de dióxido de silício na reação? Massa atômica: Si = 28 u. ; O = 16 u. ; C = 12 u.
I. 1s2 2s2.
II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 .
III. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 .
IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
Apenas o I e o III.
Apenas o III.
Apenas o II e o IV.
Apenas o IV.
Apenas o II.
No equilíbrio 2 HI (g) <===> H2 (g) + I2 (g) , encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 1 x 10-3 ?
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L
A produção de semi-condutores tem como fundamento a dopagem de um composto isolante, ou seja, contaminando um material não-condutor com alguns átomos de elementos químicos específicos, produzimos um semi-condutor. Um dos processos de produção desses semi-condutores, apresenta a reação : SiO2 (s) + 2C ( s ) -----> Si(l) + 2 CO (g) . Sabendo que esse processo apresenta um rendimento de 70% para produção de silício no estado líquido, determine a massa de silício formada quando utilizamos 450 g de dióxido de silício na reação? Massa atômica: Si = 28 u. ; O = 16 u. ; C = 12 u.
[HI] = 10 mol/L
[HI] = 0 mol/L
[HI] = 0,1 mol/L
[HI] = 3,5 mol/L
[HI] = 100 mol/L